TABLA PERIÓDICA CON NÚMEROS DE OXIDACIÓN
20 11 2013Comentarios : 1 Comment »
Categorías : 1ª Evaluación 4º ESO, 2ª Evaluación 3º ESO, TEMA 9 El enlace químico, TEMA Elementos y compuestos
IMÁGENES: ENLACES QUÍMICOS
6 11 2013En esta primera imagen vemos la relación entre la energía de enlace y la distancia entre los núcleos atómicos.
REGLA DEL OCTETO Y DIAGRAMAS DE LEWIS
Debes ver este vídeo desde le minuto 5:23 hasta el final para entender qué es la capa de valencia.
Ahora veremos los diagramas de Lewis. Una representación sencilla de los electrones de valencia:
ENLACE IÓNICO
Enlace entre un elemento metálico y otro no metálico.
Animación enlace iónico. Pincha sobre la imagen:
.
.
.
.
.
ENLACE COVALENTE
En este caso los electrones se comparten a partes iguales o uno de los átomos tiene exceso de carga negativa y el otro o los otros exceso de carga positiva. Esto ocurre entre elementos químicos no metálicos. Pero vamos por partes. Primero vamos a ver el enlace covalente entre átomos del mismo elemento químico.
.
En segundo lugar, enlace covalente entre dos átomos de diferentes elementos químicos:

.
Animación de los enlaces iónico, covalente y de hidrógeno (en inglés). Pincha sobre la imagen:
.
Veamos ahora las representaciones de Lewis para el enlace covalente:
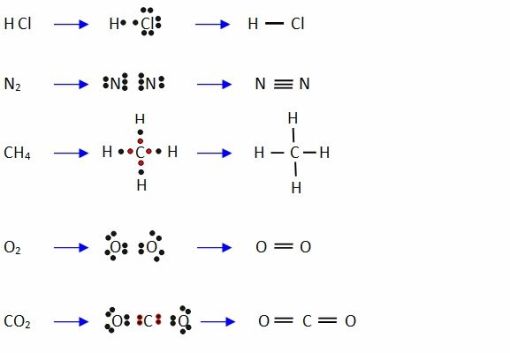
¿Qué significa enlace polar y apolar? Depende de la electronegatividad de los elementos que intervienen. Si los dos elementos tienen la misma electronegatividad el enlace es covalente apolar, si los dos elementos tienen distinta electronegatividad el par de electrones compartidos se desplaza hacia el más electronegativo apareciendo cargas parciales positiva y negativa. Observa la imagen:

.
¿Cómo se representa según Lewis?

.
Caso especial del agua:
.

.
.
ENLACE METÁLICO
Entre elementos químicos metálicos.
.

.

.

.

.
PROPIEDADES DE LAS SUSTANCIAS SEGÚN EL ENLACE QUE MANTENGA UNIDOS SUS ÁTOMOS
.
Dureza, fragilidad, ductilidad y maleabilidad:
 Enlace metálico Enlace iónico
Enlace metálico Enlace iónico
.
Disolución en agua:

.
RESUMEN
Deja tu comentario en la entrada.
.
Comentarios : Leave a Comment »
Categorías : 1ª Evaluación 4º ESO, TEMA 9 El enlace químico
Cantidad de sustancia y mol
11 11 2012Empezamos con esta imagen:
.
.
Apuntes para entender el concepto de cantidad de sustancia y mol:
Animación para entender el concepto de mol:
¿Cuál es la definición de mol? ¿Y de cantidad de sustancia?
¿De dónde parte Avogadro? Lee estos enlaces que te propongo:
http://www.profesorenlinea.cl/biografias/AvogadroAmadeus.htm
http://es.wikipedia.org/wiki/Número_de_Avogadro
Vídeos:
a) ¿Cómo saber el número de objetos de un conjunto?
.
b) Relación entre las reacciones químicas y el mol. Calculo de masa molecular y molar.
Ejercicios de aplicación fáciles:
-Ejercicios interactivos de razonamiento sobre moles, moléculas y gramos:
http://perso.wanadoo.es/cpalacio/evalua/emol.htm
-Ejercicios resueltos sencillos con vídeos explicativos:
http://profesor10demates.blogspot.com.es/2013/04/quimica-mol-moleculas-atomos-factores.html
Deja un comentario.
.
.
Comentarios : Leave a Comment »
Etiquetas: reacciones químicas
Categorías : 1ª Evaluación 4º ESO, TEMA 9 El enlace químico
ENLACES DEL TEMA 9 EL ENLACE QUÍMICO
11 11 2012Aquí tienes una gran variedad de enlaces que te ayudarán a preparar el tema.
@Se puede descargar una simulación de la disolución del cloruro de sodio (http://www.dlt.ncssm.edu/core/Chapter5-Moles-Molarity-Reaction_Types/Chapter5-Animations/Dissolving_NaCl-Electrolyte.html) y la comprobación de que conduce la corriente eléctrica (http://www.dlt.ncssm.edu/core/Chapter5-Moles-Molarity-Reaction_Types/Chapter5-Animations/Dissolving_NaCl-Electrolyte_Probe.html).
@Puedes bajarte una simulación de la transferencia de electrones entre un metal y un no metal y la formación de una estructura cristalina.
http://www.dlt.ncssm.edu/core/Chapter9-Bonding_and_Geometry/Chapter9-Animations/IonicBonding.html
@Se puede descargar una simulación de la disolución de la glucosa y la comprobación de que no conduce la corriente eléctrica.
@Ejercicios de autoevaluación sobre el enlace químico.
http://web.educastur.princast.es/proyectos/fisquiweb/Cuestionarios/enlace3.htm
@Nomenclatura y formulación inorgánica interactiva. Con la fórmula se puede obtener la nomenclatura sistemática y tradicional y con las dos nomenclaturas se compone la fórmula.
http://www.juntadeandalucia.es/averroes/recursos_informaticos/proyectos2003/quimica/index.html
@Teoría y ejercicios de formulación. La tabla periódica adjunta tiene todas las valencias. (También está en inglés)
http://www.alonsoformula.com/inorganica/
@PDF con la información básica para formular y nombrar los compuestos químicos. Junto a esto aparece un cuadro con los números de oxidación. Al final hay un listado con ejercicios y sus soluciones.
http://www.gobiernodecanarias.org/educacion/3/Usrn/fisica/FORMinORGeduana.pdf
@Formulación y nomenclatura con tabla de números de oxidación más comunes y fácil de aprender.
http://www.lamanzanadenewton.com/materiales/aplicaciones/lfq/index.html
@Formulación y nomenclatura sencillas (nivel 3º de ESO) con tablas de valencias:
http://www.juntadeandalucia.es/averroes/html/adjuntos/2008/03/25/0001/index.html
@Formulación y nomenclatura inorgánica (Sistemática y Stock) (web la tiza virtual) con ejercicios interactivos:
http://www.latizavirtual.org/quimica/quim_ino.html
@Formulación de peróxidos: http://www.bioygeo.info/Animaciones/Peroxidos.swf
@Nomenclatura y formulación de oxoácidos:
…-Caso especial del Cr, Mn, P y B (solo nomenclatura tradicional):
http://web.educastur.princast.es/proyectos/fisquiweb/Formulacion/Inorganica/AcidosCrMnPB.htm
@Nomenclatura tradicional y formulación de oxosales:
http://web.educastur.princast.es/proyectos/fisquiweb/Formulacion/Inorganica/Oxosales.htm
@Ejercicios de formulación resueltos para repasar:
http://iespmbroseta.edu.gva.es/04h_fisica/fisica_fitxa.php?camp_fisica_referencia=47
@Los enlaces químicos en el blog ¡EUREKA!
http://blog.educastur.es/eureka/4º-fyq/enlace-quimico/
@Ejercicios sobre las estructuras de Lewis
@Los tres enlaces químicos (nivel bachillerato), incluye la geometría de las moléculas covalentes.
http://www.quimi-red.com.ar/caracteristicas.htm
@Propiedades de las sustancias según el enlace
http://www.quimi-red.com.ar/propiedades_sustancias.htm#sustancias_covalentes
@Programa para calcular la cantidad de sustancia de varias muestra (se utiliza una balanza monoplato virtual)
http://www.educaplus.org/play-345-Cálculo-de-la-cantidad-de-sustancia.html
@Ejercicios de configuración electrónica de iones
http://www.educaplus.org/play-334-Ejercicios-de-configuración-electrónica.html
@Animación sobre la disolución del cloruro sódico en agua
http://www.mhhe.com/physsci/chemistry/essentialchemistry/flash/molvie1.swf
@Estructura de Lewis (explicación sencilla)
http://payala.mayo.uson.mx/QOnline/Estructura_de_Lewis.htm
@Vídeo: Clase de química sobre las estructuras de Lewis del enlace covalente (35 min)
http://www.youtube.com/watch?v=hnd2D95Dnk8
@Vídeo: Enlace metálico y estructura cristalina
http://www.youtube.com/watch?v=agaqcEg549Y&feature=related
@Vídeo: Enlace metálico (con la música de Big Bang):
http://www.youtube.com/watch?feature=fvwp&NR=1&v=VVKrYgycA8o
@Vídeo: Enlace iónico (explica la regla del octeto):
http://www.youtube.com/watch?NR=1&gl=ES&hl=es&v=_BslF3FVYEk
@Vídeo: Enlace covalente y metálico:
http://www.youtube.com/watch?gl=ES&feature=related&hl=es&v=aJH93Ee0-pI
@Vídeo: Enlaces químicos, propiedades de las sustancias (hecho por alumnos de bachillerato, muy interesante):
http://www.youtube.com/watch?v=iTaFPJGfFH0&feature=related
@Vídeo: Enlace químico (9:07) en el minuto (6:15) explica la estructura y propiedades de los sólidos iónicos:
http://www.youtube.com/watch?v=ZnLPEZYZNks
@Enlace químico Librosvivos.net:
http://www.librosvivos.net/smtc/homeTC.asp?TemaClave=1075
@Ejercicios Estructura de Lewis:
http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_iv/ejercicios/bl_4_ap_1_03.htm
@Ejercicios Tipo de enlace a partir de sus propiedades:
http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_iv/ejercicios/bl_4_ap_1_08.htm
@Animación sobre la fragilidad y disolución de las sustancias iónicas:
http://www.santamariadelpilar.es/departamentos/quimica/propiedadesionicas.htm
@ El enlace químico en el blog EUREKA:
http://blog.educastur.es/eureka/4º-fyq/enlace-quimico/
@ Masa atómica y molecular, cantidad de sustancia y mol:
http://recursos.cnice.mec.es/quimica/ulloa1/tercero/tema4/oa4/index.html
@ Concepto de mol:
http://www.hiru.com/quimica/concepto-de-mol-numero-de-avogadro
@ Ejercicios interactivos sobre moles:
http://www.ibercajalav.net/curso.php
@ Ejercicios interactivos sobre moles (platea):
http://perso.wanadoo.es/cpalacio/mol2.htm
-Enlaces químicos: Estructuras de Lewis:
http://www.lacasadeloptico.com/formacion/quimica/enlacequimico.pdf
-Enlace covalente simple, doble y triple, también enlaces polares y no polares; incluye animaciones en inglés:
http://www.genomasur.com/BCH/BCH_libro/capitulo_01.htm
-El agua: propiedades químicas:
http://biologia.laguia2000.com/bioquimica/el-agua-propiedades-quimicas
-Importancia del agua para los seres vivos:
-Los hidruros:
http://www.textoscientificos.com/quimica/inorganica/hidrogeno/hidruros
.
.
Comentarios : 1 Comment »
Etiquetas: enlace químico
Categorías : 1ª Evaluación 4º ESO, TEMA 9 El enlace químico
OBJETIVOS Y CRITERIOS DE EVALUACIÓN UD 9 EL ENLACE QUÍMICO
11 11 2012Aquí tienes una tabla con los objetivos y criterios de evaluación de esta unidad didáctica:
| OBJETIVOS | CRITERIOS DE EVALUACIÓN |
| 1. Distinguir entre átomo y molécula, conociendo los conceptos de macromolécula, red metálica y cristal iónico, para poder explicar que las propiedades de los compuestos son diferentes de las de los elementos que los componen.
2. Justificar entre qué elementos puede establecerse un enlace iónico y entre cuáles covalente y entender cómo se forma el enlace metálico.
3. Asociar el tipo de enlace con las propiedades del compuesto.
4. Relacionar el concepto de mol, cantidad de sustancia y masa molar. |
1.1. Comprende el significado del concepto enlace químico.
1.2. Distingue entre átomo, molécula, elemento, compuesto y cristal y diferenciando las propiedades de los elementos de las de los compuestos que forman.
2.1. Justifica la formación de algunos compuestos sencillos a partir de la distribución electrónica de la última capa de los elementos que los forman. 2.2. Aplica la regla del octeto para explicar los modelos de enlace iónico, covalente y metálico. 2.3. Representa mediante diagramas de Lewis las estructuras electrónicas de sustancias moleculares sencillas. 2.4. Formula previsiones sencillas sobre el tipo de enlace entre átomos del mismo o diferentes elementos y sobre las propiedades de las sustancias simples y compuestas formadas. 2.5. Describe algunas de las principales sustancias químicas aplicadas en diversos ámbitos de la sociedad: agrícola, alimentario, construcción e industrial. 2.6. Interpreta el significado de las fórmulas de las sustancias.
3.1. Relaciona algunas de las propiedades físicas de las sustancias (temperatura de fusión y ebullición, conductividad eléctrica, solubilidad en agua, etc.) con el tipo de enlace que presentan. 3.2. Explica cualitativamente con los modelos de enlace la clasificación de las sustancias según sus principales propiedades físicas. 3.3. Reconoce que el agua es un recurso natural limitado e identificar algunos de los contaminantes habituales de las aguas.
4.1. Conoce y maneja el concepto de cantidad de sustancia.
|
Comentarios : 2 Comments »
Etiquetas: criterios de evaluación 4º eso, enlace químico, objetivos 4º eso
Categorías : 1ª Evaluación 4º ESO, TEMA 9 El enlace químico




























TUS COMENTARIOS